Ácidos y Bases*
Los ácidos se clasifican de acuerdo a 3 diferentes criterios.
Clasificación de Arrhenius:
La definición de Arrhenius señalaba que ácido es toda sustancia que en disolución acuosa se ioniza para dar iones H+ (protones) o iones hidronio: H3O. Una base es toda sustancia que en disolución acuosa se ioniza para dar lugar a iones OH". De esta forma se explica el comportamiento ácido del HCl y el básico del NaOH:
HCl ↔ H+ + Cl¯
NaOH ↔ Na+ + OH¯
Clasificación de Bronsted – Lowry:
En 1923, de manera independiente, Brönsted y Lowry propusieron que los ácidos son aquellas sustancias donadoras de protones y las bases las aceptoras de protones. En disolución acuosa esta definición es prácticamente idéntica a la de Arrhenius sobre protones e hidróxidos:
2 H2O ↔ H3O+ + OH¯
Clasificación de Lewis:
Por su parte, Lewis propondría que un ácido es aquella sustancia capaz de aceptar un par de electrones. Una base corresponde entonces a una sustancia capaz de donar un par de electrones.
Una vez entendido a que se refiere un pacido y una base, hay que diferenciar lo que pasa cuando un ácido o una base entran en una solución acuosa.
Entonces, cuando nosotros agregamos un ácido, como por ejemplo el ácido muriático (HCl), éste ácido, al entrar a la disolución, se va a disociar, en otras palabras que se va separar:
HCl ↔ H+ + Cl-
Todos los ácidos y bases siguen esta regla, sin embargo no todos los ácidos se van a disociar al 100%. Esto es lo que define si un ácido es fuerte o débil. Entonces podemos enunciar que un ácido o una base son fuertes si casi el 100% de sus moléculas se disocian, por el contrario, un ácido o una base débil, no se disociarán en un 100%.
La forma más cómoda de medir estas disociaciones va a corresponder al pH.
El pH (potencial hidrógeno) se define como el logaritmo negativo de la concentración de iones hidrógeno o hidrónio.
pH = -log [H+]
La función de logaritmo es muy conveniente hablando en términos de pH. Una solución acuosa que contenga una concentración de 1 M de iones, tiene un pH = 0; si tiene una concentración 0.1, entonces el pH será de 1; de 0.001 = pH a 3. La siguiente tabla muestra la concentración real y el pH correspondiente:
| Concentración Molar de iones H+ | pH correspondiente |
| 1 | 0 |
| 0.1 | 1 |
| 0.01 | 2 |
| 0.001 | 3 |
| 0.0001 | 4 |
| 0.00001 | 5 |
| 0.000001 | 6 |
| 0.0000001 | 7 |
| 0.00000001 | 8 |
| 0.000000001 | 9 |
| 0.0000000001 | 10 |
| 0.00000000001 | 11 |
| 0.000000000001 | 12 |
| 0.0000000000001 | 13 |
| 0.00000000000001 | 14 |
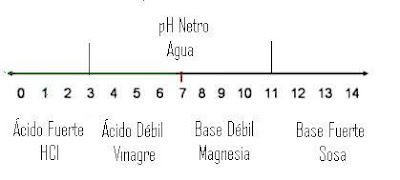
Como el lector podrá notar, cada vez que el pH se hace más grande la concentración molar de iones H+ es cada vez menor. De esta manera vamos a distinguir una escala de pH. Esta escala va de 0 a 14. El pH de 7 corresponde a las sustancias neutras, como el agua o los jabones neutros.
* Existen 4 formas de medir el pH dependiendo si es ácido fuerte o débil o base fuerte y débil
a continuación se muestran las 4 fórmulas
ácido fuerte-----pH= -log [H+]
ácido débil------pH= 1/2(-logKa) -1/2 log C
base débil-------pH= pKw - 1/2(-logKb) + 1/2 log C
base fuerte------pH= pKw - pOH
pOH= -log [OH-]
Ka= Cte. de disociación ácida
C= concentración
Kb= Cte. de disociación básica
pKw= 14
[ ]= Concentración
Ecuación Henderson - Hasselbach
pH= pK + [base conjugada] / [ácido] ó pH= pK - [ácido] / [base conjugada]

OK. Nos ayuda a entender de una manera practica lo que son las cosas. La quimica no es mi materia favorita pero medio le entiendo. Esta es una excelente guia
ResponderEliminareste fondo negro esta padre pero la tabla casi no se ve profe
ResponderEliminar