Tipos de Reacciones
Cada vez en nosotros convertimos la energía de los alimentos en energía, se están llevando a cabo dentro de nuestros cuerpos una gran cantidad de reacciones químicas.
La manera en que en química se expresa algún cambio en la materia, corresponde a una ecuación matemática denominada ecuación química.
Este tipo de ecuaciones reconocen a dos factores principales. Tomemos por ejemplo la reacción con la que se crea agua:
2H2 + O2 → 2H2O
En este caso, tenemos que distinguir los componentes de las ecuaciones químicas.
Por un lado tenemos a los reactivos. Estas sustancias son las que van a reaccionar, las que van a cambiar sus propiedades químicas para la formación de algún otro tipo de molécula. Volviendo a nuestra ecuación, los reactivos corresponderán al Oxígeno y al Hidrógeno (los que reaccionarán) y el agua corresponderá al producto (sustancia que se va a formar con la reacción de los reactivos)
2H2 + O2 → 2H2O
Reactivos → Productos
De igual manera, como algunas reacciones químicas son reversibles, en otras palabras y usando nuestro ejemplo, es posible que de la unión de Hidrógeno y Oxígeno se forme agua, pero también es posible que de la descomposición del agua se forme Hidrógeno y Oxígeno, entonces es necesario representar las ecuaciones no como una igualdad, si no como una ecuación vectorial, en la que es necesario establecer el sentido de la reacción, en otras palabras, especificar si se forma agua o se descompone el agua.
Para solucionar ese problema, las ecuaciones químicas no usan el signo igual, por el contrario utilizan una flecha para determinar que, en este caso, se crea agua a partir de Hidrógeno y Oxígeno.
2H2 +O2 → 2H2O
La flecha indica la dirección de la reacción
como el hidrógeno y el oxígeno se unen para formar agua
Las ecuaciones químicas también deben de especificar si se utilizó algún tipo de energía para formar o descomponer al compuesto. En el caso del agua, cuando se somete a electricidad, se da la electrólisis del agua, en otras palabras, la descomposición del agua y la formación de Hidrógeno y Oxígeno gaseoso.
En este caso la ecuación sería la siguiente
2H2 + O2 → 2H2O o bien 2H2O → 2H2 + O2
Ya que se indica con la flecha el sentido de la reacción, es indistinto el orden de los productos o reactivos, aunque por conveniencia, casi siempre los reactivos se escriben del lado izquierdo. Ahora bien, para representar la aplicación de energía eléctrica para la hidrólisis del agua, se dibuja un símbolo arriba de la flecha:
▲ Este símbolo representa la energía
2H2O → 2H2 + O2
2CaO → 2Ca + O2
Además de estas representaciones, las ecuaciones también pueden incluir los estados de agregación de la materia como letras en paréntesis al lado de los reactivos o productos:
2H2O (l) → 2H2 (g) + O2 (g)
Ahora bien, ya identificamos las principales características de las ecuaciones. A continuación veremos las características de las reacciones químicas. Una reacción química no es más que un reacomodo de núcleos y electrones. Ahora hacemos referencia a los principales tipos de reacciones químicas:
Reacción de Síntesis.
En este tipo de reacciones, reaccionan dos o más reactivos para formar un producto:
A + B → AB
Reacciones de Descomposición.
Este tipo de reacciones es contrario a las de síntesis, ya que un reactivo produce dos o más productos:
AB → A + B
Reacciones de sustitución simple.
En estas reacciones uno de los reactivos “intercambia” el lugar con otro.
AB + C → AC + B
Reacciones de doble sustitución.
En estas reacciones dos reactivos intercambian lugar.
AB + CD → AD+ CB
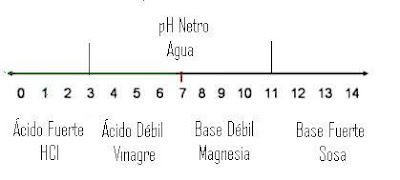
Reacciones de neutralización.
Únicas de ácidos con bases, en estas reacciones siempre los reactivos serán un ácido y una base y los productos serán una sal y agua. Por ejemplo la formación de NaCl o sal común.
Base + Ácido→ Sal + Agua
NaOH + HCl → NaCl + H2O
Comentarios
Publicar un comentario